CÁC BẬC NHÂN TÀI KHOA HỌC 34
(ĐC sưu tầm trên NET)
| 100 |  John Dalton và thuyết nguyên tử, cở sở hóa học hiện đại
John
Dalton (6 tháng 9, năm 1766 – 27 tháng 7, năm 1844) là một nhà hóa học,
nhà vật lý người Anh. Ông sinh ra trong một gia đình dệt vải nghèo tại
Eaglesfield, một vùng phía Tây Bắc nước Anh. Thời niên thiếu, để có đủ
điều kiện tiếp tục theo học và đeo đuổi lòng đam mê khoa học của mình,
John Dalton phải trốn nhà để đi trợ giảng ở một trường trung học tại
Kendan (khi ấy, ông chỉ mới 15 tuổi). Vài năm sau,...
 John
Dalton (6 tháng 9, năm 1766 – 27 tháng 7, năm 1844) là một nhà hóa học,
nhà vật lý người Anh. Ông sinh ra trong một gia đình dệt vải nghèo tại
Eaglesfield, một vùng phía Tây Bắc nước Anh. Thời niên thiếu, để có đủ
điều kiện tiếp tục theo học và đeo đuổi lòng đam mê khoa học của mình,
John Dalton phải trốn nhà để đi trợ giảng ở một trường trung học tại
Kendan (khi ấy, ông chỉ mới 15 tuổi). Vài năm sau, khi Dalton 19 tuổi,
ông đã được cử giữ chức hiệu trưởng trường trung học này. Về sau, ông
trở nên nổi tiếng vì những đóng góp, lý giải của ông trong thuyết nguyên
tử và các nghiên cứu của ông về bệnh mù màu. Lý thuyết về nguyên tử của
Dalton là cơ sở để xây dựng các lý thuyết khác về nguyên tử sau này. John
Dalton (6 tháng 9, năm 1766 – 27 tháng 7, năm 1844) là một nhà hóa học,
nhà vật lý người Anh. Ông sinh ra trong một gia đình dệt vải nghèo tại
Eaglesfield, một vùng phía Tây Bắc nước Anh. Thời niên thiếu, để có đủ
điều kiện tiếp tục theo học và đeo đuổi lòng đam mê khoa học của mình,
John Dalton phải trốn nhà để đi trợ giảng ở một trường trung học tại
Kendan (khi ấy, ông chỉ mới 15 tuổi). Vài năm sau, khi Dalton 19 tuổi,
ông đã được cử giữ chức hiệu trưởng trường trung học này. Về sau, ông
trở nên nổi tiếng vì những đóng góp, lý giải của ông trong thuyết nguyên
tử và các nghiên cứu của ông về bệnh mù màu. Lý thuyết về nguyên tử của
Dalton là cơ sở để xây dựng các lý thuyết khác về nguyên tử sau này.Trong năm 1790 Dalton đã định chọn ngành luật hay y khoa, nhưng dự định của ông không được khuyến khích của những người thân, nên ông vẫn ở lại Kendal đến tận mùa xuân năm1793 ông mới di chuyển đến Manchester. Dalton được bổ nhiệm làm một giáo viên dạy toán và khoa học tự nhiên ở Học viện Manchester. Ông ở vị trí này đến tận trường này đựoc di chuyển đến York vào năm 1803, khi đó ông trở thành một giáo viên dạy toán và dạy hóa, vừa dạy công và dạy tư. Phương pháp sống của Dalton chịu ảnh hưởng sâu sắc của một tín đồ phái giáo hữu (Quaker), một nhà khí tượng học xuất sắc, người đã làm ông quan tâm đến những vấn đề của toán học và khí tượng học. Năm 1787 ông bắt đầu giữ các ghi chép của ông về khí tượng học [1] ông đã đưa vào đó hơn 200.000 những quan sát. Ấn bản đầu tiên của ông là Các luận văn và quan sát khí tượng (Meteorological Observations and Essays) (năm 1793), trong đó có nhiều ý tưởng là tiền đề cho các phát minh của ông sau đó. Một tác phẩm khác của Dalton là Những nguyên lý cơ bản của Ngữ pháp tiếng Anh (Elements of English Grammar), được xuất bản năm 1801. Năm 1794 ông được bầu vào làm thành viên của Hội Triết học và Văn chương Manchester (ManchesterLiterary and Philosophical Society) Thuyết nguyên tử Các nguyên tử và phân tử khác nhau trong mô hình của John Dalton trong ấn phẩm Hệ thống mới của triết học hóa học (A New System of Chemical Philosophy (xuất bản năm 1808). Vào năm 1808, John Dalton đã đưa ra lý thuyết nguyên tử của ông để giải thích định luật bảo toàn khối lượng và định luật tỷ lệ các chất trong các phản ứng hoá học. Lý thuyết của ông dựa trên năm giả thuyết. Giả thuyết thứ nhất phát biểu rằng tất cả vật chất đều được tạo thành từ các nguyên tử. Giả thuyết thứ hai là các nguyên tử của cùng một nguyên tố sẽ có cùng một cấu trúc và tính chất. Giả thuyết thứ ba là các nguyên tử không thể bị phân chia, không thể được sinh ra hoặc mất đi. Giả thuyết thứ tư là các nguyên tử của các nguyên tố khác nhau kết hợp với nhau để tạo ra các hợp chất. Giả thuyết thứ năm là trong các phản ứng hoá học, các nguyên tử có thể kết hợp, phân tách hoặc tái sắp xếp lại. Lý thuyết của Dalton không chỉ giải thích các định luật trên mà còn là cơ sở để xây dựng các lý thuyết khác về nguyên tử sau này. Cha đẻ thuyết nguyên tử 2.600 năm trướcNhà hiền triết và triết gia Ấn Độ Acharya Kanad được coi là người đặt nền móng đầu tiên cho thuyết nguyên tử hơn hai nghìn năm trước.
John Dalton (1766 - 1844), nhà vật lý và hóa học người Anh được biết đến
hiện nay là người đặt nền móng cho lý thuyết về nguyên tử. Tuy nhiên,
theo Ancient Origins, Acharya Kanad đã phát triển lý thuyết nguyên tử trước Dalton 2.500 năm.
Acharya Kanad sinh năm 600 trước Công Nguyên tại Prabhas Kshetra (gần Dwaraka), Ấn Độ. Tên thật của ông là Kashyap.
Cái tên Kanad (lấy từ Kan trong tiếng Phạn, nghĩa là "hạt nhỏ nhất") bắt
nguồn từ chuyến hành hương của ông đến Prayag. Những người hành hương
trong đoàn làm vương vãi hoa và gạo mà họ cúng tế tại chùa. Ông đi theo
nhặt từng hạt một. Khi được hỏi tại sao lại nhặt những hạt gạo mà cả ăn
xin cũng không lấy, ông nói rằng một hạt thì không có giá trị gì, nhưng
hàng trăm hạt sẽ đủ cho bữa ăn của một người, nhiều bữa ăn sẽ nuôi sống
một gia đình, và cuối cùng, toàn thể nhân loại được xây dựng lên từ
những gia đình. Do đó một hạt gạo đơn lẻ cũng quan trọng như tất cả của
cải giá trị trên thế giới. Acharya trong tên ông có nghĩa là "giáo
viên".
Kanad theo đuổi niềm đam mê với thế giới vô hình và khái niệm hóa các ý
tưởng về các hạt nhỏ nhất. Ông ghi lại những ý tưởng đó và dạy lại cho
người khác.
Khái niệm nguyên tử của Kanad có được khi ông cố gắng phá vỡ thực phẩm
thành những hạt nhỏ rồi nhận ra không thể phá vỡ được nữa vì các hạt quá
nhỏ. Ông gọi những hạt mà không thể phá vỡ thêm được là parmanu hay anu
(nguyên tử).
Acharya Kanad cũng cho rằng những vật chất nhỏ này con người không thể
cảm nhận qua các bộ phận hay quan sát bằng mắt thường, và bằng cách nào
đó mà các parmanu kết hợp với nhau. Khi hai parmanu của cùng một chất
kết hợp, chúng sẽ tạo ra một dwinuka (phân tử đôi).
Dwinuka có tính chất tương tự như hai parmanu sinh ra nó. Theo ông, các
chất khác nhau là do được tạo thành bởi các sự kết hợp khác nhau của các
parmanu. Ông cũng đưa ra ý tưởng rằng các nguyên tử có thể kết hợp theo
nhiều cách khác nhau tạo ra các thay đổi hóa học, nhờ có sự hiện diện
của các yếu tố khác, như nhiệt. Các dẫn chứng chứng minh ý tưởng này ông
đưa ra là sự chín của trái cây hay sự tạo thành của lớp nhọ nồi trên
nồi đất.
Acharya Kanad mở trường dạy triết học để truyền đạt các ý tưởng về
nguyên tử và bản chất của vũ trụ. Ông viết một cuốn sách tựa đề
"Vaisheshik Darshan" về nghiên cứu của mình và được coi là "cha đẻ của
thuyết nguyên tử".
Ở phương Tây, trường phái nguyên tử bắt đầu được biết đến vào khoảng thế
kỷ thứ 5 trước Công Nguyên, với các tác giả Hy Lạp cổ đại Leucippus và
Democritus. Vấn đề văn hóa Ấn Độ có chịu ảnh hưởng của Hy Lạp hoặc ngược
lại, hay hai bên phát triển độc lập vẫn đang là một vấn đề tranh cãi.
Kanad được cho là đã viết "mỗi vật thể được cấu tạo bởi các nguyên tử
khi chúng kết nối với nhau để tạo thành phân tử". Tuy lý thuyết của ông
chỉ là các khái niệm trừu tượng sơ sài, bó buộc trong phạm vi triết học,
bởi chúng chỉ dựa trên logic chứ không có thí nghiệm hay thực nghiệm,
nhưng theo nhà nghiên cứu về Ấn Độ nhiều kinh nghiệm A.L. Basham thì
"chúng là những sự giải thích các cấu trúc vật lý bằng tưởng tượng tuyệt
vời, tương đồng với các khám phá vật lý hiện đại".
Nguyễn Thành Minh
|
John Dalton 1766-1844 Vương Quốc Vật Lý, Hóa Học |
| 101 |  VÀI NÉT VỀ CHARLES DE COULOMB (1736 - 1806) Charles
Augustin de Coulomb, nhà vật lý Pháp, người đã có công tìm ra định luật
về tương tác tĩnh điện, Ông sinh ngày 14-6-1736 tại Angoulême, một
thành phố nhỏ ở tây nam nước Pháp, cách Paris hơn 500 km. Charles
Augustin de Coulomb, nhà vật lý Pháp, người đã có công tìm ra định luật
về tương tác tĩnh điện, Ông sinh ngày 14-6-1736 tại Angoulême, một
thành phố nhỏ ở tây nam nước Pháp, cách Paris hơn 500 km.
Thuở nhỏ, Coulomb là
một học sinh cần cù và thông minh, tốt nghiệp xuất sắc trường trung học
và trường đại học, rồi trở thành sĩ quan công binh trong quân đội Pháp.
Nhu cầu xây dựng trong công binh đã thúc đẩy ông đi vào nghiên cứu lý
thuyết về cơ học. Năm 1773, Coulomb xây dựng thành công những cơ sở lý
thuyết về sức bền vật liệu. Năm 1779, ông công bố những công trình về
nguyên lý các máy đơn giản và các định luật ma sát. Năm 1781, ông là
viện sĩ Viện Hàn lâm Khoa học Paris. Ba năm sau, Coulomb hoàn thành
những công trình nghiên cứu xuất sắc về sự xoắn đàn hồi của những sợi
dây nhỏ, và phát minh ra định luật về lực xoắn mà dựa vào đó, ông chế
tạo ra dụng cụ để đo các lực nhỏ, gọi là cái "cân xoắn".
Năm 48 tuổi, Coulomb
bắt đầu nghiên cứu các lực điện và lực từ, những nghiên cứu này đã làm
cho tên tuổi của ông trở thành bất tử. Trong những năm 1785 - 88, ông
công bố những kết quả đầu tiên về phép đo lực đẩy và lực hút giữa các
điện tích bằng cân xoắn. Tiếp tục thí nghiệm tương tự với các cực từ,
cuối cùng ông đã phát biểu thành các định luật về sau được mang tên ông.
Coulomb cũng nghiên cứu về trường từ, cách chế tạo kim nam châm, cách
khử từ, và đã khám phá ra sự phân bố điện tích ở mặt ngoài vật dẫn, biết
hiệu ứng màn tĩnh điện, đề ra khái niệm momen từ, đồng thời xây dựng lý
thuyết về hiện tượng phân cực điện môi. Những nghiên cứu của ông đã
giúp xác lập được phương pháp đo các điện tích và từ tính. Nhờ đó, từ
đây, có thể xây dựng lý thuyết toán học về các hiện tượng điện từ.
Coulomb mất năm 1806, hưởng thọ 70 tuổi. Để ghi nhớ công lao của ông,
người ta đã dùng tên ông để đặt cho đơn vị điện lượng.
Một điều khá thú vị
là mặc dù những công trình về điện học của Culông là rất quan trọng
nhưng theo giới khoa học lúc bấy giờ, Culông là một người không chuyên
về điện!
Lực tĩnh điệnBách khoa toàn thư mở Wikipedia
Bài
viết này cần thêm chú thích nguồn gốc để kiểm chứng thông tin. Mời bạn
giúp hoàn thiện bài viết này bằng cách bổ sung chú thích tới các nguồn
đáng tin cậy. Các nội dung không có nguồn có thể bị nghi ngờ và xóa bỏ.
Lực tĩnh điện là lực giữa hai vật mang điện tích đứng yên. Nó là trường hợp đặc biệt của lực Lorentz (lực điện từ tổng quát).
Lực này được Coulomb, nhà bác học người Pháp,
dựa trên ý tưởng về sự tương tự giữa điện học và cơ học, giữa sự tương
tự của hai vật và hai điện tích, tìm ra lần đầu cho hai điện tích điểm và phát biểu thành định luật Coulomb. Trong trường hợp tương tác giữa hai điện tích điểm, lực tĩnh điện còn được gọi là lực Coulomb.
Định luật Coulomb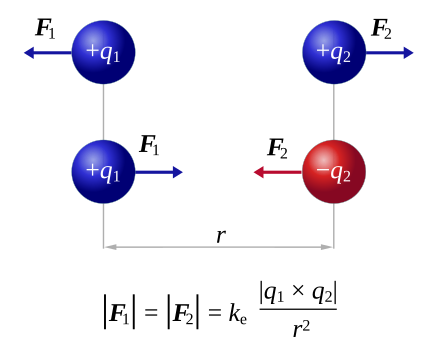
Sơ đồ mô tả cơ chế cơ bản của định luật Coulomb; cùng điện tích thì đẩy nhau và khác điện tích thì hút lẫn nhau.
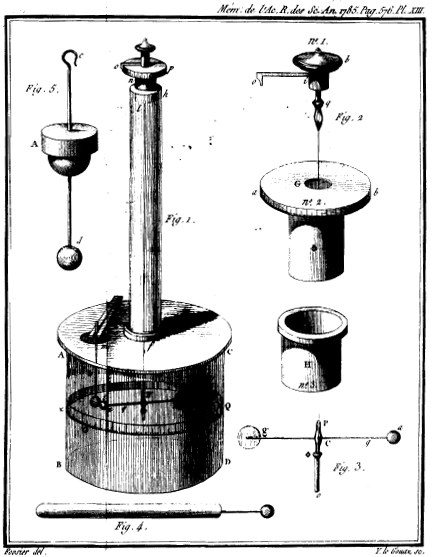
Cân xoắn Coulomb
Độ lớn của lực được tính theo công thức:
 và và  là các véc-tơ vị trí của các điện tích điểm. là các véc-tơ vị trí của các điện tích điểm.
Định luật Coulomb là một trong các định luật vật lý thể hiện lực giảm theo bình phương khoảng cách, giống định luật hấp dẫn Newton. Hằng số lực Coulomb lớn hơn nhiều lần hằng số hấp dẫn (G) trong SI nên lực Coulomb có độ lớn gấp nhiều lần độ lớn lực hấp dẫn. Định luật Coulomb chỉ đúng khi lực Coulomb được quan sát trong hệ quy chiếu trong đó các điện tích điểm đứng yên. Khi các điện tích chuyển động, các điện tích gây ra dòng điện, tạo nên từ trường theo định luật Ampere, và tương tác với nhau theo lực Lorentz. Tương tác lúc này có thể coi là tương tác trong điện trường tương đối tính như miêu tả bởi thuyết tương đối của Albert Einstein. Lực tĩnh điện tổng quátĐể tính lực tĩnh điện giữa hai vật mang điện tích, có thể chia các vật ra thành nhiều vật nhỏ hơn. Nếu phép chia tiến đến một giới hạn nào đó, vật nhỏ mang điện sẽ trở thành các điện tích. Khi đó có thể áp dụng nguyên lý chồng chất cho lực tĩnh điện (hay còn gọi là nguyên lý tác dụng độc lập).Lực tĩnh điện do N điện tích điểm gây ra bằng tổng vectơ của lực tĩnh điện do từng điện tích điểm gây ra. Có thể định nghĩa môi trường xung quanh một vật mang điện là điện trường. Khi một vật khác nằm trong môi trường này, lực tĩnh điện vật đó sẽ chịu là: Điện trườngTừ công thức trên,với q là điện tích của vật đó và E là cường độ điện trường của điện trường. Cách chứng minh định luật Coulomb đơn giảnChúng ta có thể chứng minh định luật Coulomb bằng một thí nghiệm đơn giản. Cho hai quả cầu nhỏ với khối lượng và cùng điện tích và cùng điện tích  , được treo trên hai sợi dây với chiều dài là , được treo trên hai sợi dây với chiều dài là  và khối lượng không đáng kể. Có ba lực tác dụng lên quả cầu lúc đó: trọng lực và khối lượng không đáng kể. Có ba lực tác dụng lên quả cầu lúc đó: trọng lực  , lực căng dây , lực căng dây  và lực điện và lực điện  . .
Trong trạng thái cân bằng, ta có  (1) và (1) và  (2). (2).
Lấy (1) chia cho (2), ta được: 
Cho L1 là khoảng cách giữa các quả cầu khi đã tích điện. Giả định rằng nếu định luật Coulomb đúng thì lực đẩy giữa hai quả cầu sẽ là 
Vậy:  . .
Nếu giờ ta chỉ tích điện một quả cầu và cho hai quả tác dụng với nhau, mỗi quả cầu sẽ có lượng điện tích là  . Trong trạng thái cân bằng, khoảng cách giữa hai quả cầu là . Trong trạng thái cân bằng, khoảng cách giữa hai quả cầu là  và lực đẩy giữa chúng sẽ là: và lực đẩy giữa chúng sẽ là:
|
Charles-Augustin de Coulomb 1736-1806 Pháp Vật Lý |
 Antonine Laurent de Lavoisier - Niềm đam mê hóa học.
Antonine Laurent de Lavoisier (1743-1794) là nhà hóa học vĩ đại Pháp. Vào thời đó "Thuyết nhiên tố" đang thống trị châu
 Âu
hàng trăm năm (Đây là thuyết hết sức sai lầm về sự cháy ở thế kỷ 18).
Năm 1777, ông thông qua một báo cáo nghiên cứu có tựa đề là "Khái niệm về sự cháy", đã vạch ra những sai lầm của "Thuyết nhiên tố", ông đã chứng minh sự cháy chỉ là một loại tác dụng oxy hóa sinh ra từ vật chất với khí oxy. Âu
hàng trăm năm (Đây là thuyết hết sức sai lầm về sự cháy ở thế kỷ 18).
Năm 1777, ông thông qua một báo cáo nghiên cứu có tựa đề là "Khái niệm về sự cháy", đã vạch ra những sai lầm của "Thuyết nhiên tố", ông đã chứng minh sự cháy chỉ là một loại tác dụng oxy hóa sinh ra từ vật chất với khí oxy.
Ông lần đầu tiên đặt tên cho "Hidro", là
người đầu tiên dùng phương trình hóa học để ghi lại quá trình phản ứng
hóa học. Năm 1789 "Giáo trình cơ bản về hóa học" nổi tiếng của ông đã
hoàn thành cuộc cách mạng hóa học, thay đổi triệt để hướng đi của cách
mạng hóa học.
Quyết định không làm luật sư
Antonine Laurent de Lavoisier sinh ra trong một gia
đình luật sư ở Pari nước Pháp. Cha ông là người làm về luật nhưng lại có
rất nhiều bạn bè là nhà khoa học, họ là những người mà khi Antonine còn
nhỏ rất hâm mộ. Chỉ cần bạn bè là những nhà khoa học của cha đến nhà là
Antonine tích cực giúp mẹ bê trà. Khi mọi người nói chuyện, cậu Antonine nhỏ ngồi bên cạnh chú ý lắng nghe. Antonine dần dần mê khoa học, lúc nhỏ đã tự học thiên văn học, toán học, hóa học, địa chất học và thực vật học.
Có một lần nhân dịp nghỉ hè, cậu Antonine nhỏ theo
ông Kâyta - nhà nghiên cứu khoáng vật nổi tiếng, bạn của cha vào rừng
cùng ông vẽ bản đồ địa chất. Ở đó Antonine đã học được rất nhiều kiến
thức về khoáng vật lý thú.
Chẳng mấy chốc đã tốt nghiệp trung học, Antonine vào
Đại học học Luật theo ý nguyện của cha, với người yêu thích khoa học ông
đã làm việc chẳng mấy thú vị.
 Vì
thích hóa học nên khi học ở đại học, Antonine một mặt học luật, mặt
khác ông dành thời gian đi nghe bài của một nhà hóa học nổi tiếng. Ngoài
việc nghe bài ra, ông còn đến thư viện đọc rất nhiều sách về hóa học. Vì
thích hóa học nên khi học ở đại học, Antonine một mặt học luật, mặt
khác ông dành thời gian đi nghe bài của một nhà hóa học nổi tiếng. Ngoài
việc nghe bài ra, ông còn đến thư viện đọc rất nhiều sách về hóa học.
Antonine đã từng nói với bạn học: "Đối với tôi, học pháp luật là nhiệm vụ, còn học hóa học là hứng thú".
Ngoài hứng thú ra, còn một nguyên nhân nữa đó là: Khi kiến thức hóa học
của ông học được nhiều lên, ông cảm thấy sâu sắc rằng trong lĩnh vực
hóa học còn rất nhiều điều đang đợi mọi người đi sâu tìm hiểu và giải
quyết.
Antonine tốt nghiệp đại học, ông có được chứng nhận học vị luật và cả giấy phép hành nghề luật sư. Mẹ ông rất vui, đặc biệt là cha ông vì con trai ông sẽ kế thừa sự nghiệp của ông.
Năm đó Antonine mới 20 tuổi, khi ngồi trong phòng
luật sư nổi tiếng của cha mình ông vẫn không biết tại sao mình lại ngồi
đây? Ông không có một chút hứng thú nào với công việc này, ông thường
ngồi lặng lẽ nhìn ra cửa sổ như người mất hồn.
Cha ông nhìn thấy vậy liền hỏi: "Con làm gì thế?"
Antonine đứng dậy, mắt vẫn nhìn ra ngoài, lơ đãng trả lời: "Con nghĩ là con nên rời khỏi nơi này!"
Cha ông như không chịu nổi: "Con nói gì? Con ngồi xuống cho bố xem nào!"
"Con muốn rời khỏi đây"
- ông trả lời cha một cách quả quyết, một lúc sau rời khỏi văn phòng
luật sư của cha mình. Và cho đến tận sau này, Antonine vẫn là một nhà
hóa học vĩ đại.
"Không dựa vào phán đoán mà phải căn cứ vào thực tế"-- Antonine Laurent de Lavoisier --
------------------------------------ Thực nghiệm lớn của Lavoisier
05/03/2006 09:24 -
Bất kỳ ai trong chúng ra hiện nay đều hiểu rằng nước
được kết hợp từ oxy va hiđro. Thế nhưng ở thế kỷ 18, người ta còn hoàn
toàn chưa biết điều này. Chỉ tới năm 1785 , khi Antoine Lavoisier chứng
minh bằng thực nghiệm rằng nước là một hợp chất được tạo thành từ hai
loại khí: oxy và hiđro thì lịch sử hóa học có thêm một cột mốc mới.
“Nước
không phải là đơn chất[...]. Nó có khả năng phân rã cũng như tái tạo
lại”. Antoine Lavoisier đã khẳng định như vậy trong bài phát biểu vào
ngày 12 tháng 11 năm 1783 trước phiên họp toàn thể của Viện Hàn lâm khoa
học Paris. Lời khẳng định này được đưa ra sau khi Antoine Lavoisier
tiến hành các thực nghiệm rất tốn kém kéo dài trong nhiều tháng trời và
nó hoàn toàn ngược lại với quan niệm của nhiều nhà hóa học thời đó khi
cho rằng nước là một đơn chất. Vào tháng 4 năm 1784, Lavoisier tiếp tục
đưa ra các kết quả nghiên cứu mới trước Viện Hàn lầm để khẳng định tuyên
bố của mình nhưng cộng đồng khoa học lúc đó vẫn tiếp tục nghi ngờ.
Không nản lòng, Lavoisier tiếp tục một đợt thực nghiệm lớn diễn ra từ
ngày 27/2 cho tới 1/3/1785 trước sự chứng kiến của một hội đồng các nhà
khoa học gồm các nhà hóa học lớn của Viện Hàn lâm và nhiều khách mời
quan trọng.
Các thực nghiệm này đã chứng minh được rằng nước có thể phân thành hai chất khác nhau sau đó hai chất này với cùng tỉ lệ kết hợp lại với nhau để trở thành nước như ban đầu. Nhằm mục đích khẳng định và củng cố giả thiết đưa ra ban đầu, các thực nghiệm này thực sự đã trở thành một sự kiện, một cột mốc quan trọng trong lịch sử của ngành hóa học. Chúng đã phá vỡ bức màn bao phủ về thành phần tự nhiên của nước và cung cấp các bằng chứng có tính chất quyết định cho quan niệm hóa học của Lavoisier, chống lại lý thuyết nhiên tố vốn rất thịnh hành lúc bấy giờ. Những thực nghiệm của Lavoisier đã chứng tỏ được rằng tổng khối lượng của các chất khí sử dụng tương
Lúc mới bắt đầu nghiên cứu khoa học, Lavoisier quan sát các chất cháy trong không khí, thí dụ như phốt pho, lưu huỳnh, cacbon, kim loại dễ nóng chảy như chì, thiếc và ông nhận thấy khối lượng của các chất này tăng lên. Điều này chứng tỏ có một cái gì đó trong không khí đã được thêm vào chất đang cháy. Ông tiến hành các thực nghiệm theo giả thiết đó và viết kết quả vào một cuốn sách có tên Cẩm nang về vật lý và hóa học (Opuscule physiques et chimies), xuất bản năm 1774. “Khí cơ bản” hay oxy Dù vậy thì Lavoisier vẫn chưa thể xác định, nói cụ thể hơn là cô lập và đặt tên được cái chất có trong không khí thường xuất hiện trong mỗi lần cháy. Mà nó lại được Joseph Priestley, một nhà hóa học tên tuổi người Anh xác định ra vào ngày 1/8/1774 và ông này đặt tên là khí ngược nhiên tố (air déphlogistiqué). Nhiên tố, hay còn gọi là thành phần cơ bản của tính gây cháy là một nguyên lý chi phối sự cháy của các chất. Theo cách lý giải như vậy, không khí chứa một phần khí ngược nhiên tố và đa phần khí nhiên tố. Cách lý giải này dường như phù hợp với các quan niệm của các nhà hóa học lúc đó. Lavoisier lặp lại các thí nghiệm của Priesley nhưng áp dụng nguyên tắc bảo toàn khối lượng. Bằng việc chấp nhận về mặt chất lượng quan sát của nhà hóa học người Anh, ông nhấn mạnh tới sự không tương thích về trọng lượng mà người ta thấy rất rõ. Ông xác định phần khí tham gia vào sự cháy là phần khí lành nhất hoặc có thể hít được. Ông đặt tên nó là khí cơ bản vào năm 1775 nhưng ông vẫn thường dùng từ khí ngược nhiên tố như cách gọi thông dụng của các nhà hóa học thời bấy giờ. Nhưng quan niệm của Lavoisier về sự cháy là như thế nào? Theo ông, một chất khí được tạo lên từ một thành phần cơ bản (mà giờ chúng ta gọi là một nguyên tố hóa học) cùng với một chất liệu tạo cháy (matière de chaleur) mà sau này ông đặt tên là chất dinh dưỡng. Như vậy, trên nền của chất tạo cháy này, vào năm 1777, nhà hóa học đặt tên nó là oxygine, một từ có gốc từ tiếng Hy Lạp nghĩa là “chất tạo axit). Thực tế phải tới năm 1787, ông mới sử dụng chính thức cái tên này. Nguyên lý axit đã giúp Lavoisier tạo ra một lý thuyết về hóa học mới và suốt nửa cuối cuộc đời, ông giành thời gian để chứng minh điều này. Với việc tiến hành ngày càng nhiều thực nghiệm hơn, Lavoisier buộc phải cần làm việc nhóm để tiến hành các thí nghiệm trên những máy móc ngày càng phức tạp và đòi hỏi thời gian nhiều hơn. Ông hợp tác với Pierre Simon Laplace và nhà quân nhân kiêm kỹ sư Bastiste Meusnier vào đầu những năm 1780. Lúc này, Lavoisier đã đưa ra giả thiết rằng nước được tạo thành từ hai chất: oxy và hiđro. Sau một thực nghiệm phân tách các thành phần của nước vào năm 1784, công việc còn lại của ông là chứng minh giả thiết của mình cùng bằng thực nghiệm tương tự nhưng có thêm phần tái tạo lại nước từ chính các chất vừa phân tách được ra. Đây là một thực nghiệm lớn được tiến hành năm 1785. Sản xuất hiđro cho khinh khí cầu Nhưng tại sao Lavoisier lại có được ý tưởng này? Khí hiđro lúc đầu được đặt tên là khí dễ cháy và do nhà hóa học người Anh Henry Cavendish phát hiện ra vào năm 1766. Do có khối lượng cực nhẹ và dễ cháy, người ta đã từng cho rằng hiđro là một thiên tố thuần túy. Rất có khả năng kể từ năm 1781, Cavendish là người đầu tiên thừa nhận rằng nước là sản phẩm duy nhất của khí dễ cháy có trong khí cơ bản mà Friestley đã khẳng định vào năm 1783. Cả hai nhà bác học này giả định rằng khí dễ cháy được tạo thành từ nước và thiên tố, dù nó có là thiên tố thuần túy hay không. Chính vì vậy, họ cho rằng nước được tạo thành khi người ta kết hợp hai chất khí này lại. Vào mùa hè năm 1783, cả Gaspard Monge và Lavoisier đều nhận thấy chỉ có nước được tạo ra từ hỗn hợp của hai loại khí này.
Mục tiêu của thực nghiệm lớn chưa từng thấy này lúc đầu là phân tích thành phần của nước khi tác động với sắt-thực chất là hơi nước nóng tác động với sắt tạo ra oxit sắt và giải phóng khí hiđro. Sau đó, đốt khí hiđro trong oxy để tổng hợp nước trở lại. Khối lượng của các chất tham gia phản ứng và chất tạo thành phải tương đương với nhau trong hai thực nhiệm. Từ thực nghiệm này, Lavoisier khẳng định rằng nước không phải là một sản phẩm đơn chất. Biên bản sơ sài và người vô danh Meusnier là người được giao nhiệm vụ viết biên bản chi tiết của hai cuộc thực nghiệm nhưng vì là quân nhân, vào cùng thời điểm đó, ông nhận lệnh dẫn quân đi bảo vệ khu vực công trình cảng Cherbourg. Thời gian quá gấp gáp khiến ông không hoàn thành được biên bản hai cuộc thực nghiệm như Lavoisier mong muốn. Tuy nhiên, một bản báo cáo khác xuất hiện vào ngày 27/2/1786 trong một tạp chí khoa học mới ra đời, tờ báo Journal polytype. Biên bản này, rất có khả năng do Lavoisier viết, mở đầu bằng việc nhận định phương pháp tiến hành thực nghiệm khoa học, sau đó nhắc tới các khám phá của Cavendish, Monge và các nhà khoa học khác. Tác giả của báo cáo cũng miêu tả chi tiết việc phân tách nước, việc tiến hành đốt khí hiđro, các dụng cụ thí nghiệm, các biện pháp an toàn, các nghiên cứu tiến hành trước thực nghiệm và kết quả cũng như bình luận các kết quả này. Biên bản này chắc hẳn đã được đánh máy rất vội vã do vậy có rất nhiều lỗi in ấn và nó sau này được viết lại rõ ràng hơn vào năm 1892 trong quyển V của bộ sách Các tác phẩm của Lavoisier. Trong lần tái bản này, nhiều thuật ngữ như oxy, hiđro, oxy hóa... đã được sử dụng và chúng hoàn toàn khác lạ so với bản gốc. Tuy nhiên, chúng lại là tất cả những gì mà Lavoisier muốn đưa ra giúp các nhà khoa học thời đó hiểu rõ hơn về các công việc mà ông đã thực hiện. Chính vì vậy, rất nhiều nhà hóa học lúc đó đã nhanh chóng theo và bảo vệ học thuyết của Lavoisier, thí dụ như Claude Berthollet, Louis Guyton de Morveau, Antoine de Fourcroy..
Hoàng An
Nguồn tin: Lược dịch từ Pour la Science No 336-10/2005 Lavoisier – cha đẻ của hoá học hiện đạiĐăng lúc: Thứ tư - 29/02/2012 13:33 - Người đăng bài viết: Phan Trọng QuỳnhLavoisier mồ côi mẹ khi mới 5 tuổi. Ông theo học trường trung học Mazarin từ năm 1754 đến năm 1761. Từ năm 1761 đến năm 1763, ông học luật tại Đại học Paris và ông nhận bằng cử nhân luật năm 1763. Trong khoảng thời gian này, ông cũng đã thể hiện tài năng về những môn khoa học tự nhiên của mình Ông đã cống hiến hết sức lực và niềm đam mê của mình cho môn hóa học với việc ông muốn giành được học bổng lớn hồi bấy giờ là học bổng Étienne Condillac. Công trình hóa học đầu tiên của ông hoàn thành năm 1764. Ở tuổi 25, ông được xem là một người có rất nhiều triển vọng trong tương lai với tinh thần học hỏi và một trí tuệ tuyệt vời.
Antoine Laurent de Lavoisier – Nhà hoá học người Pháp sinh ngày 26 tháng 8 năm 1743 tại
Paris- Pháp. Ông được xem là một trong những nhà hoá học vĩ đại nhất
trong lịch sử. Ông đã xây dựng nên Định luật bảo toàn khối lượng, tìm ra
thành phần của nước gồm hai nguyên tố là hiđrô và ôxi. Năm 1777, ông đề
ra thuyết về sự ôxi hóa các chất, đập tan sự thống trị từ nhiều thế kỷ trước đó của thuyết nhiên tố do Georg Ernst Stahl đề xuất. Năm 1785, ông phát triển thuyết ôxi
hoá, chỉ ra vai trò của oxi trong các quá trình ôxy hoá. Năm 1787, ông
xuất bản cuốn “Danh pháp hoá học” với sự cộng tác của 3 nhà hoá học Pháp
có tên tuổi. Hai năm sau ông công bố tác phẩm “Khoá luận về hoá học”,
hệ thống hoá kiến thức tích luỹ được thời bấy giờ về hoá học. Ngoài ra,
ông cũng quan tâm ứng dụng hoá học vào sinh học và là người đầu tiên
chứng minh nhiệt động vật là kết quả của quá trình đốt cháy chất hữu cơ
đối với gluxit. Ngay từ năm 1780, ông đóng vai trò quyết định trong việc
xây dựng ở châu Âu một mạng lưới quốc tế các trạm khí tượng. Với những
đóng góp đó, ông trở nên bất tử trong ngành hóa học, được xem là cha đẻ
của ngành hóa học hiện đại tuy nhiên vì những bất ổn của xã hội Pháp cuối thế kỷ 18 mà đỉnh điểm là cuộc Cách mạng Pháp năm 1789 đã khiến ông bị xử tử ngày 4 tháng 5 năm 1794 vì nghi ngờ có dính dáng đến hoạt động của giới quý tộc khi ông 51 tuổi.
Lavoisier mồ côi mẹ khi mới 5 tuổi. Ông theo học trường trung học Mazarin từ năm 1754 đến năm 1761. Từ năm 1761 đến năm 1763, ông học luật tại Đại học Paris và ông nhận bằng cử nhân luật năm 1763.
Trong khoảng thời gian này, ông cũng đã thể hiện tài năng về những môn
khoa học tự nhiên của mình Ông đã cống hiến hết sức lực và niềm đam mê
của mình cho môn hóa học với việc ông muốn giành được học bổng lớn hồi
bấy giờ là học bổng Étienne Condillac. Công trình hóa học đầu tiên của ông hoàn thành năm 1764. Ở tuổi 25, ông được xem là một người có rất nhiều triển vọng trong tương lai với tinh thần học hỏi và một trí tuệ tuyệt vời.
Trước thế kỷ 18, hóa học bị chi phối bởi thuyết nhiên tố của Georg Ernst Stahl và Johann Joachim Becher,
tất cả các phản ứng đều được giải thích theo thuyết nhiên tố và tuy nó
bộc lộ rất nhiều sơ hở và mâu thuẫn nhưng vẫn được chấp nhận vì vẫn chưa
có lý thuyết nào thay thế được nó. Cho đến giữa thế kỷ 18 đã xuất hiện
những đòn công kích thuyết nhiên tố trong đó có nhà bác học Nga Mikhail Vasilyevich Lomonosov
nhưng ông mới chỉ cho thấy những mâu thuẫn của thuyết này mà chưa giải
thích được tại sao lại có các mâu thuẫn đó nhưng nó đã làm cho thuyết
nhiên tố không còn đứng vững như trước nữa. Và cuối cùng vào năm 1774, Lavoisier khi làm thí nghiệm đốt nóng kim loại
trong bình kín đã có một phát minh mới vô cùng quan trọng đó là khi
biến thành một chất khác, kim loại đã hấp thu một trọng lượng gần bằng
1/5 không khí
trong bình. Từ đó, ông đã đi đến kết luận rằng trong quá trình biến đổi
hóa học, kim loại đã hấp thu một thành phần nào đó của không khí mà
thành phần đó bằng đúng 1/5 trọng lượng không khí chứ không hề có chất
gì gọi là nhiên tố cả. Và chính thí nghiệm trên của Lavoisier đã chứng
minh được rằng sự cháy là sự kết hợp của kim loại và một thành phần của
không khí mà về sau ông gọi là ôxi.
Năm 1777, ông đề ra thuyết ôxi hóa và tuy bị một số người phản đối thế nhưng đã lôi kéo được nhiều nhà khoa học lớn trong đó có Claude Louis Berthollet, người nhờ 17 công trình khoa học về thuyết nhiên tố mà đã được bầu vào Viện Hàn lâm Khoa học Paris.
Trong khoảng thời gian từ 1778 đến năm 1782, ông trực tiếp phụ trách xưởng chế tạo thuốc súng, nghiên cứu nông nghiệp và đưa ra nhiều cải tiến có giá trị. Năm 1782, ông cùng một số nhà hóa học nổi tiếng khác định ra quy tắc thống nhất về cách gọi tên các hợp chất hóa học đặt nền móng cho sự phân loại các chất. Toàn bộ nhưng công trình trên của ông đã khiến cho thuyết nhiên tố tồn tại nhiều thế kỷ qua sụp đổ.
Để tổng kết các công trình của mình, năm 1789 Lavorsier đã xuất bản cuốn sách “Khái luận về hoá học”. với những hình vẽ tuyệt vời do vợ ông minh họa. Cuốn sách gây chấn động thề giới và lập tức được dịch ra nhiều thứ tiếng như tiếng Anh, tiếng Đức, tiếng Hà Lan, tiếng Tây Ban Nha, tiếng Ý,... Chỉ 2 năm sau khi cuốn sách ra đời, người đứng đầu thuyết nhiên tố là Richard Kirwan đã đầu hàng vô điều kiện.
Cuộc
cách mạng hóa học vào cuối thế kỷ 18 đã hoàn tất. Trong lúc đó, tình
hình xã hội Pháp trải qua nhiều biến động mà đỉnh điểm là cuộc Cách mạng Pháp năm 1789.
Lavorsier với những hoạt động chính trị và kinh doanh liên quan đến
giới quý tộc như tham gia đầu tư, quản trị của công ty thu thuế cá nhân Ferme Générale;
chủ tịch uỷ ban của Discount Bank (sau đổi tên thành Banque de France);
và là một thành viên giàu quyền lực trong một số hội đồng quản trị quý
tộc khác và nhất là việc ông trở thành một chuyên viên thu thuế đã khiến
ông trở thành một đối tượng của cách mạng. Người tham gia kết tội ông
là Antoine Fouqier-Tinville, ủy viên công tố của phái Jacobin dựa trên những lời kết tội của một nhà khoa học khác là Jean-Paul Marat, một người có nhiều mâu thuẫn với Lavorsier. Và mặc dù Maximilien Robespierre, người đứng đầu phái Jacobin đã tìm ra những lý lẽ bào chữa cho ông như việc ông tìm ra trọng lượng của hệ metric
mới và chế tạo thuốc súng nhưng ông vẫn bị đem ra xét xử vào ngày 4
tháng 5 năm 1784 và bị kết án tử hình. Trước khi bị xử tử, ông đã xin
phép được hoàn thành nốt một thí nghiệm quan trọng nhưng quan tòa nói
rằng: "Nền cộng hòa không cần các nhà khoa học hay hóa học..." và ông bị
xử tử ngay chiều hôm đó. Nhà toán học Joseph Louis Lagrange,
một trong những người bạn của ông, đã phát biểu: "Chỉ trong phút chốc
người ta chặt cái đầu của Lavorsier nhưng nước Pháp trong một trăm năm
nữa cũng không thể tìm đâu được một cái đầu như thế!". Hai tháng sau,
Robespierre bị lật đổ và hành quyết còn Fouquier-Tinville cũng lên máy
chém một năm sau đó.
Lavoisier, nhân loại mãi cảm ơn ông làm cho hoá học đi bằng hai chân, trong khi trước đó họ đi lộn ngược bằng đầu.
Tác giả bài viết: Phan Hữu Trọng
Lịch sử của định luật bảo toàn khối lượngpdf - 2 trangkhối lượng Định luật bảo toàn khối lượng hay định luật Lomonosov-Lavoisier là một định luật cơ bản trong lĩnh vực hóa học, được phát biểu như sau: Trong phản ứng hóa học, tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng sản phẩm tạo thành. Định luật bảo toàn khối lượng được hai nhà khoa học Mikhail Vasilyevich Lomonosov và Antoine Lavoisier khám phá độc lập với nhau qua những thí nghiệm được cân đo chính xác, từ đó phát hiện ra định luật bảo toàn khối lượng. * Năm 1748, nhà hóa học người Nga Mikhail Vasilyevich Lomonosov đặt ra định đề. * Năm 1789, nhà hóa học người Pháp Antoine Lavoisier phát biểu định luật này. Khi cân những bình nút kín đựng bột kim loại trước và sau khi nung, M.V.Lomonosov nhận thấy rằng khối lượng của chúng không thay đổi, mặc dù những chuyển hoá hoá học đã xãy ra với kim loại trong bình. Khi áp dụng các phương pháp định lượng nghiên cứu phản ứng hoá học, năm 1748 Lomonosov đã tìm định luật quan trọng này. Lomonosov trình bày định luật như sau: "Tất cả những biến đổi xảy ra trong tự nhiên thực chất là nếu lấy đi bao nhiêu ở vật thể này, thì có bấy nhiêu được thêm vào ở vật thể khác. Như vậy, nếu ở đây giảm đi bao nhiêu vật chất, thì sẽ có từng ấy vật chất tăng lên ở chổ khác". Bản chất Trong phản ứng hoá học có sự thay đổi liên kết giữa các nguyên tử,sự thay đổi này chỉ liên quan đến các điện tử còn số nguyên tử của mỗi nguyên tố được giữ nguyên và khối lượng của các nguyên tử không đổi, vì thế tổng khối lượng các chất được bảo toàn. Định luật này đôi khi còn được gọi là Định luật bảo toàn trọng lượng của các chất, vì ở cùng một địa điểm trọng lượng tỷ lệ với khối lượng. Lomonosov cũng nhận thấy rằng bảo toàn năng lượng cũng có giá trị đối với các phản ứng hóa học. |
Antoine Lavoisier 1743-1794 Pháp Hóa Học, |














Nhận xét
Đăng nhận xét